Аминокислоты входящие в состав белков строение номенклатура. Аминокислоты - структурные мономеры белков
Пора выяснить что такое аминокислоты, для чего они нужны и как их правильно принимать.
Аминокислоты служат «строительным материалом» для белков, поскольку благодаря уникальной последовательности 21 вида данных органических соединений в организме образуются все типы белков и мышечные ткани. В плане химического строения, аминокислоты характеризуются наличием аминогруппы с атомом азота, которая является основой данного соединения.
Присутствие атома азота отличает аминокислоты от других питательных веществ, которые мы получаем из пищи (например, углеводов), вот почему это — единственные соединения, которые способны образовывать ткани, органы, мышцы, кожу и волосы.
Сейчас, когда люди слышат о белке, они автоматически думают лишь мышцах и бодибилдинге, хотя аминокислоты являются значимым компонентом диеты любого человека, но в особенности это важно для тех, кто занимается каким-либо видом спорта. Аминокислоты обычно делятся на 3 категории: незаменимые, полузаменимые и заменимые.
Что подразумевается под словом «незаменимые»? «Незаменимые» означает, что эти аминокислоты не могут быть синтезированы в организме и должны поступать в него с пищей. Существует 9 незаменимых аминокислот, в числе которых знаменитая группа ВСАА.
Аминокислоты с разветвленными боковыми цепями (ВСАА)
Лейцин, изолейцин и валин
Из 9-ти незаменимых аминокислот 3 относятся к категории аминокислот с разветвленными цепями. Это лейцин, изолейцин и валин. ВСАА имеют уникальное химическое строение по сравнению с другими незаменимыми аминокислотами, и поэтому обладают особыми свойствами. В отличие от остальных аминокислот, ВСАА быстрее и лучше усваиваются организмом, то есть они абсорбируются не в желудке, а фактически поступают непосредственно в мышцы. Чтобы узнать больше о ВСАА, читайте нашу статью «ВСАА. Что такое аминокислоты с разветвленными цепями?».
Другие незаменимые аминокислоты
Остальные незаменимые аминокислоты: гистидин, метионин, фенилаланин, треонин, триптофан и лизин, – необходимы организму для выполнения ряда физиологических функций.
Гистидин
Гистидин – ароматическая аминокислота, которая выполняет ряд жизненно важных функций в организме, в том числе участвует в синтезе гемоглобина, функционировании иммунной системы и восстановлении тканей. Гистидин является важной аминокислотой в период роста человека, а также при реабилитации после болезни.
Лизин
Лизин играет важную роль в функционировании иммунной системы. Он также наряду с полузаменимыми кислотами участвует в синтезе коллагена, чтобы кожа, волосы и ногти оставались здоровыми.
Триптофан
Триптофан – это незаменимая ароматическая аминокислота, которая содержит ядро индола. Она выполняет ряд функций в организме, в частности играет роль химического посыльного в нервной системе. В отличие от других аминокислот, L-триптофан не растворяется в воде и устойчив к теплу, то есть в процессе обработки не теряет большую часть полезных свойств.
Метионин
Метионин — это аминокислота с неприятным запахом (содержит атом серы), которая является предшественником других аминокислот, таких как таурин. Ее антиоксидантные свойства способны защищать организм, подавляя в нем действие вредных веществ. Она также участвует в построении белков и выработке различных гормонов, в том числе адреналина и мелатонина.
Фенилаланин
Фенилаланин является неполярной аминокислотой, которая обладает бензильной боковой цепью и известна своими антидепрессантными свойствами. Она играет важную роль в выработке допамина и адреналина.
Треонин
Эта аминокислота является полярной незаряженной, и после усвоения преобразуется в пируват, играя важную роль в производстве глюкозы и выработке энергии АТФ.
Заменимые аминокислоты
Заменимыми аминокислотами называются те, которые могут быть синтезированы организмом. У вас может возникнуть следующий вопрос: «Если они вырабатываются в организме, тогда зачем мы должны принимать их дополнительно?». Дело в том, что во время физических упражнений, после того как энергия в виде углеводов исчерпана, организм начинает искать другие источники питания. Аминокислоты могут выступать в качестве такого источника, чтобы обеспечить мышцы всем необходимым для продолжения тренировки. Однако организм часто не способен достаточно быстро вырабатывать аминокислоты для удовлетворения возросших во время тренировки потребностей, потому мы должны потреблять их в большем количестве независимо от того, являются они заменимыми или нет.

Аланин
Аланин – одно из простейших органических соединений с точки зрения химической структуры, которое классифицируется как неполярная аминокислота. Аланин играет ключевую роль в глюкозо-аланиновом цикле между печенью и тканями организма. Проще говоря, он вступает в реакцию в тканях, чтобы образовать пируват, а затем глюкозу для использования ее в качестве источника энергии.
Глицин
Глицин – самая маленькая из всех аминокислот, которая связана с выработкой коллагена, а также пролина и лизина. Помимо этого она выступает в качестве нейромедиатора в спинном мозге, стволе головного мозга и сетчатке.
Аспарагиновая кислота
Эта аминокислота участвует в цикле мочевины в организме, а также в процессе, который называется глюконеогенезом (метаболический путь, приводящий к образованию глюкозы). Помимо этого аспарагиновая кислота действует как нейромедиатор, стимулирующий определенные рецепторы в нервной системе.
Аспарагин
Аспарагин необходим для нормальной работы нервной системы, а также он играет важную роль в синтезе аммиака.
Полузаменимые или условнозаменимые аминокислоты
Эти аминокислоты могут вырабатываться организмом в определенном количестве, однако в некоторых обстоятельствах этого количества недостаточно для нормального физиологического функционирования, например во время болезни или при интенсивных тренировках.

Серин
Серин – это протеиногенная аминокислота, которая выполняет ряд биологических функций в организме. Он играет важную роль в метаболизме, ферментативных реакциях и работе мозга.
Аргинин
Аргинин является прекурсором оксида азота. Он уменьшает время восстановления после травм, ускоряет заживление поврежденных тканей и способствует снижению и стабилизации артериального давления.
Тирозин
Тирозин – это протеиногенная аминокислота, которая играет важную роль в передаче сигналов в клетках.
Пролин
Эта аминокислота обладает исключительно жесткой структурой, которая используется для синтеза коллагена, необходимого для поддержания здоровья волос, кожи и ногтей.
Орнитин
Орнитин играет ключевую роль в биосинтезе мочевины, а также, как предполагается, предотвращает появление усталости во время тренировок. Цикл мочевины – это ряд биохимических процессов, в результате которых образуется мочевина для выведения аммиака из организма.
Глутамин
Глутамин является одной из самых популярных полузаменимых аминокислот среди спортсменов, которая участвует в регуляции кислотности в почках, создании клеточной энергии и стимулировании мышечного метаболизма.
Цистеин
Цистеин играет важную роль в ферментативных реакциях в организме. Считается, что он принимает участие в связывании металлов, а также является предшественником определенных антиоксидантов.
Польза и применение аминокислот
Теперь разберемся для чего нужны аминокислоты и для достижения каких целей они эффективны. Аминокислоты являются неотъемлемой частью нашего организма и тех процессов, которые в нем ежедневно происходят. Поддержание должного баланса аминокислот путем употребления добавок продемонстрировало большую пользу для организма от стимулирования мышечного роста до улучшения функций иммунной системы.
Мышечный анаболизм, снижение мышечной усталости и помощь в восстановлении мышц
Самая большая польза добавок с аминокислотами заключатся в их способности стимулировать мышечный анаболизм, восстанавливать мышцы и предотвращать появления мышечной усталости.
Лейцин, изолейцин, валин, аспарагин, аспарагиновая кислота и глутамин – это те 6 аминокислот, которые метаболизируются в мышцах в состоянии покоя. Они поддерживают многочисленные метаболические процессы, например, играют основополагающую роль субстратов для синтеза белка и образования энергии, а также являются предшественником глутамина и аланина.
В течение первых 10 минут физических упражнений в организме происходит реакция с участием фермента аланинаминотрансфераза с целью поддержания высокого уровня определенных аминокислот во время тренировки. Промежуточные соединения, которые образуются в результате этой реакции, могут вызывать появление усталости. Однако глутамин выполняет ряд функций в организме, которые позволяют использовать его в качестве источника питания, поэтому глутаминовые добавки способны повышать мышечную энергию и уровень мышечного метаболизма во время тренировок.

Эти полезные свойства добавок с аминокислотами делают их идеальными не только для бодибилдеров, но и для бегунов, спринтеров, а также для людей, ведущих активный образ жизни.
В 2000 году был проведен эксперимент с целью определить реакцию мышечного белка на прием аминокислот. Шесть мужчин и женщин употребляли напиток, содержащий 6 г незаменимых аминокислот или напиток-плацебо, спустя 1 час после тренировки. У тех, кто принимал аминокислоты, наблюдалось увеличение уровня фенилаланина, чего не происходило среди тех, кто принимал плацебо. Это увеличение вызывало анаболический отклик в мышцах, поэтому был сделан вывод о том, что аминокислоты стимулируют белковый анаболизм и синтез белка в мышцах.
Кроме того, в 2003 году в одном из научных обзоров было сказано, что увеличенная концентрация лейцина в организме способна стимулировать синтез мышечного белка при катаболическом состоянии, вызванном ограничениями в пище или утомительными тренировками.

Аминокислоты для похудения
Аминокислоты полезны не только для тех, кто хочет нарастить мышцы и улучшить их восстановление, но они также показаны как средство, способствующее избавлению от лишнего веса. В одном из исследований наблюдались 2 группы людей, желающих похудеть и изменить состав тела. Первая группа использовала диету с высоким содержанием аминокислот, а вторая – с низким.
Спустя 16 дней обнаружилось, что группа, принимавшая большее количество аминокислот, потеряла значительно больше жира и меньше мышечной массы, чем другая. В целом, данные свидетельствуют о том, что диета с повышенным содержанием белка и аминокислот и низким содержанием углеводов обеспечивает бо́льшую потерю жира, сохраняя при этом в организме белок.

Диабет
Сахарный диабет – это заболевание, при котором организм не в состоянии эффективно регулировать уровень сахара в крови и вырабатывать инсулин. Когда мы потребляем углеводы, уровень глюкозы в организме возрастает. При диабете организм не способен должным образом вырабатывать инсулин, чтобы вернуть уровень сахара в норму, в результате чего развивается гипергликемия. Аминокислоты положительно влияют на уровень сахара в крови. Например, аргинин является предшественником оксида азота, передающего вещества, которое оказывает прямое влияние на чувствительность к инсулину.

Воспаление и артрит
Еще одно полезное свойство аминокислот заключается в том, что они могут снижать активность воспалительных процессов в организме. В ходе одного исследования, проведенного в 1973 году, было доказано, что эфиры аминокислот и серосодержащие аминокислоты, в том числе цистеин и метионин, являются эффективными противовоспалительными агентами, которые способны уменьшать последствия отеков и анафилактического шока, и даже снижать воспаление и улучшать состояние при адъювант-индуцированном артрите.

Иммунная система
Хотя это может являться новостью для вас, но дефицит пищевого белка или аминокислот ослабляет функции иммунной системы и увеличивает восприимчивость к болезням. В частности, современные исследования показывают, что аргинин, глутамин и цистеин играют важную роль в работе иммунной системы. Например, эти аминокислоты участвуют в активации различных лимфоцитов, естественных клеток-киллеров и макрофагов, вмешиваются в редокс-регуляцию клеточных функций, экспрессию генов и пролиферацию лимфоцитов, а также влияют на выработку антител, цитокинов и других цитотоксичных субстанций. Сегодня ученые приходят к выводу, что добавки, содержащие определенный набор аминокислот, могут улучшить состояние иммунной системы и снизить уровень заболеваемости и смертности.
Рождаемость
Недавние исследования доказывают, что добавки с аминокислотами способны поднять уровень рождаемости. Например, в одном из таких исследований участвовали 132 мужчины с нарушениями фертильности. В течение 3 месяцев они принимали добавки с аминокислотами и микроэлементами. В качестве контрольной выступала группа из 73 мужчин с пониженной плодовитостью (субфертильностью), которые принимали плацебо. Все результаты исследования испытуемой группы показали значительное улучшение в области зачатия, по сравнению с контрольной группой. В течение 6 месяцев после завершения эксперимента в группе мужчин принимавших добавки было зафиксировано 34 случая зачатия.
Надеюсь, у вас больше не осталось вопросов зачем нужны аминокислоты, если есть, всегда можно задать вопрос в комментариях.
Добавки с аминокислотами
Если вы получаете все необходимые питательные вещества с пищей, то добавки могут вам не понадобиться. Однако стоит помнить о том, что во время тренировок потребность организма в аминокислотах повышается, поэтому если вы много тренируетесь и хотите нарастить мышцы или похудеть, то, скорее всего добавки будут вам необходимы. Вариантов аминокислот множество, зайдите в любой магазин, они могут быть в порошковой форме, в виде таблеток или капсул.
Аминокислоты в порошке
Аминокислоты в форме порошка выпускаются с различными вкусами, поэтому вы легко можете их добавлять в ваш любимый сок или воду.
Аминокислоты в таблетках
У вас нет ни минуты свободного времени и нужно срочно принять суточную дозу аминокислот? Добавки в форме таблеток идеально подходят для таких ситуаций.
Имейте ввиду, что роль аминокислот в спортивном питании очень велика, чем их больше, тем лучше. Нет смысла брать высокоуглеводистый гейнер, проще купить кило сахара и размешать его с протеином, выйдет дешевле.
Как принимать аминокислоты?

Добавки с аминокислотами лучше всего принимать утром, до тренировки, после тренировки и перед сном, чтобы снизить мышечную усталость и максимизировать мышечный анаболизм и восстановление.
Как правильно принимать аминокислоты того или иного вида, всегда указано на банке. Например, BCAA лучше всего принимать утром после пробуждения, до и после тренировки. Комплексные аминки употребляйте между основными приемами пищи, а также до и после тренировки. Для правильного потребления остальных видов, необходимо учитывать какие еще добавки вы потребляете.
I. Физико-химическая – основана на различиях в физико-химических свойствах аминокислот. 1) Гидрофобные аминокислоты (неполярные). Компоненты радикалов содержат обычно углеводородные группы и ароматические кольца. К гидрофобным аминокислотам относятся ала, вал, лей, иле, фен, три, мет. 2) Гидрофильные (полярные) незаряженные аминокислоты . Радикалы таких аминокислот содержат в своем составе полярные группировки (-ОН, -SH, -NH2). Эти группы взаимодействуют с дипольными молекулами воды, которые ориентируются вокруг них. К полярным незаряженным относятся гли, сер, тре, тир, цис, глн, асн. 3) Полярные отрицательно заряженные аминокислоты. К ним относятся аспарагиновая и глутаминовая кислоты. В нейтральной среде асп и глу приобретают отрицательный заряд. 4) Полярные положительно заряженныеаминокислоты : аргинин, лизин и гистидин. Имеютдополнительную аминогруппу (или имидазольное кольцо, как гистидин) в радикале. В нейтральной среде лиз, арг и гαис приобретают положительный заряд.
II. Биологическая классификация.1) Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать с пищей (вал, иле, лей, лиз, мет, тре, три, фен) и еще 2 аминокислоты относятся к частично незаменимым (арг, гис). 2)Заменимые аминокислоты могут синтезироваться в организме человека (глутаминовая кислота, глутамин, пролин, аланин, аспарагиновая кислота, аспарагин, тирозин, цистеин, серин и глицин).Строение аминокислот . Все аминокислоты являются α-аминокислотами. Аминогруппа общей части всех аминокислот присоединена к α-углеродному атому. Аминокислоты содержат карбоксильную группу –COOH и аминогруппу -NH2. В белке ионогенные группы общей части аминокислот участвуют в образовании пептидной связи, и все свойства белка определяются только свойствами радикалов аминокислот. Аминокислоты амфотерные соединения.Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом.
2. Физико-химические свойства белков. Выделение и очистка: электрофоретическое разделение, гель-фильтрация и др. Молекулярная масса белков, амфотерность, растворимость (гидратация, высаливание). Денатурация белков, ее обратимость.
1. Молекулярная масса . Белки – высокомолекулярные органические азотсодержащие полимеры, построенные из аминокислот. Молекулярная масса белков зависит от количества аминокислот в каждой субъединице. 2. Буферные свойства. Белки – амфотерные полиэлектролиты, т.е. они сочетают в себе кислые и основные свойства. В зависимости от этого белки могут быть кислыми и основными. 3. Факторы стабилизации белка в растворе . ГИДРАТНАЯ ОБОЛОЧКА – это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами. 4. Факторы, снижающие растворимость белков . Значение рН, при котором белок становится электронейтральным, называется изоэлектрической точкой (ИЭТ) белка. Для основных белков ИЭТ находится в щелочной среде, для кислых – в кислой среде. Денатурация – это последовательное нарушение четвертичной, третичной, вторичной структур белка, сопровождающееся потерей биологических свойств. Денатурированный белок выпадает в осадок. Осадить белок можно, изменяя рН среды (ИЭТ), либо высаливанием, либо действуя каким-либо фактором денатурации. Физические факторы:1. Высокие температуры. Часть белков подвергается денатурации уже при 40-502. Ультрафиолетовое облучение 3. Рентгеновское и радиоактивное облучение 4. Ультразвук 5. Механическое воздействие (например, вибрация). Химические факторы:1. Концентрированные кислоты и щелочи. 2. Соли тяжелых металлов (например, CuSO4). 3. Органические растворители (этиловый спирт, ацетон) 4. Нейтральные соли щелочных и щелочноземельных металлов (NaCl, (NH4)2SO4)
3. Структурная организация белковых молекул. Первичная, вторичная, третичная структуры. Связи, участвующие в стабилизации структур. Зависимость биологических свойств белков от вторичной и третичной структуры. Четвертичная структура белков. Зависимость биологической активности белков от четвертичной структуры (изменение конформации протомеров).
Существует четыре уровня пространственной организации белка: первичная, вторичная, третичная и четвертичная структура белковых молекул.Первичная структура белка - последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот. Вторичная структура - это пространственная организация стержня полипептидной цепи в виде α-спирали или β-складчатой структуры. В α-спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. β-Складчатая структура удерживается также водородными связями между С=О и NH-группами. Третичная структура - особое взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-дер-ваальсовые взаимодействия). Четвертичная структура – трехмерная организация в пространстве несколькихполипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками.
4. Простые и сложные белки, их классификация. Характер связей простетических групп с белком. Биологические функции белков. Способность к специфическим взаимодействиям с лигандом.
Простые белки построены из остатков аминокислот и при гидролизераспадаются соответственно только на свободные аминокислоты.Сложные белки – это двухкомпонентные белки, которые состоят изкакого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты еераспада.Простые белки в свою очередь делятся на основании некоторых условновыбранных критериев на ряд подгрупп: протамины, гистоны, альбумины,глобулины, проламины, глютелины и др. Классификация сложных белков: фосфопротеины(содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины(содержат углеводы), липопротеины (содержат липиды) и металлопротеины(содержат металлы).Активный центр белковой молекулы. При функционировании белков может происходить их связывание с лигандами – низкомолекулярными веществами. Лиганд присоединяется к определенному участку в белковой молекуле – активному центру. Активный центр формируется на третичном и четвертичном уровнях организации белковой молекулы и образуется благодаря притяжению боковых радикалов определенных аминокислот (между -ОН группами сер формируются водородные связи, ароматические радикалы связаны гидрофобными взаимодействиями, -СООН и –NH2 - ионными связями).
Углеводсодержащие белки (гликопротеины и протеогликаны). Простетическая группа гликопротеинов может быть представлена моносахаридами (глюкозой, галактозой, маннозой, фруктозой, 6-дезоксигалактозой), их аминами и ацетилированными производными аминосахаров (ацетилглюкоза, ацетилгалактоза. На долю углеводов в молекулах гликопротеинов приходится до 35%. Гликопротеины преимущественно глобулярные белки. Углеводный компонент протеогликанов может быть представлен несколькими цепями гетерополисахаридов.Биологические функции гликопротеинов:1. транспортная (белки крови глобулины транспортируют ионы железа, меди, стероидные гормоны); 2. защитная : фибриноген осуществляет свертывание крови; б. иммуноглобулины обеспечивают иммунную защиту; 3. рецепторная (на поверхности клеточной мембраны расположены рецепторы, которые обеспечивают специфическое взаимодействие).4. ферментативная (холинэстераза, рибонуклеаза); 5. гормональная (гормоны передней доли гипофиза – гонадотропин, тиреотропин). Биологические функции протеогликанов: гиалуроновая и хондроитинсерная кислоты, кератинсульфат выполняют структурную, связующую, поверхностно-механическую функции.
6. Липопротеины тканей человека. Классификация липидов. Основные представители: триацилглицерины, фосфолипиды, гликолипиды, холестериды. Их структура и функции. Незаменимые жирные кислоты и их производные. Состав, строение и функции липопротеинов крови.
![]()
7. Нуклеопротеины. Особенности белковой части. История открытия и изучения нуклеиновых кислот. Структура и функции нуклеиновых кислот. Первичная и вторичная структура ДНК и РНК. Виды РНК. Строение хромосом.
Нуклеопротеины - сложные белки, в состав которых входит белок (протамин или гистон), небелковая часть представлена нуклеиновыми кислотами (НК): дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеиновой кислотой (РНК). Протамины и гистоны – белки с резко выраженными основными свойствами, т.к. они содержат более 30% арг и лиз. Нуклеиновые кислоты (НК) - это длинные полимерные цепи, состоящие из многих тысяч мономерных единиц, которые соединяются между собой 3`,5`- фосфоди-эфирными связями. Мономером НК является мононуклеотид, который состоит из азотистого основания, пентозы и остатка фосфорной кислоты. Азотистые основания бывают пуриновые (А и Г) и пиримидиновые (Ц, У, Т). В качестве пентозы выступает β– Д- рибоза или β –Д- дезоксирибоза. Азотистое основание соединено с пентозой N-гликозидной связью. Пентоза и фосфат связаны друг с другом сложноэфирной связью между –ОН группой, расположенной у С5’-атома пентозы, и фосфатом. Виды нуклеиновых кислот: 1. ДНК содержит А, Г, Т и Ц, дезоксирибозу и фосфорную кислоту. ДНК находится в ядре клетки и составляет основу сложного белка хроматина. 2. РНК содержит А, Г, У и Ц, рибозу и фосфорную кислоту. Различают 3 вида РНК: а) м-РНК(информационная или матричная) – копия участка ДНК, содержит информацию о структуре белка; б) р-РНК образует скелет рибосомы в цитоплазме, выполняет важную роль при сборке белка на рибосоме в процессе трансляции; в) т-РНК участвует в активации и транспорте АК к рибосоме, локализована в цитоплазме. НК имеют первичную, вторичную и третичную структуры. Первичная структура НК одинакова для всех видов – линейная полинуклеотидная цепь, в которой мононуклеотиды связаны 3’, 5’-фосфодиэфирными связями. Каждая полинуклеотидная цепь имеет 3’ и 5’ , эти концы заряжены отрицательно. Вторичная структура ДНК представляет собой двойную спираль. ДНК состоит из 2-х цепей, закрученных в спираль вправо вокруг оси. Виток спирали = 10 нуклеотидов, что составляет в длину 3,4 нм. Обе спирали антипараллельны. Третичная структура ДНК. Это результат дополнительного скручивания в пространстве молекулы ДНК. Это происходит при взаимодействии ДНК с белком. При взаимодействии с октамером гистона двойная спираль накручивается на октамер, т.е. превращается в суперспираль. Вторичная структура РНК – полинуклеотидная нить, изогнутая в пространстве. Эта изогнутость обусловлена образованием водородных связей между комплементарными азотистыми основаниями. У т-РНК вторичная структура представлена «клеверным листом», в котором различаю комплементарные и некомплементарные участки. Вторичная структура р-РНК – спираль одиночной изогнутой РНК, а третичная – скелет рибосомы. Поступая из ядра в ЦЗ, м-РНК образует со специфическими белками – информомерами комплексы (третичная структура м-РНК ) и называются информосомами.
8. Хромопротеины, их классификация. Флавопротеины, их структура и функции. Гемопротеины, структура, представители: гемоглобин, миоглобин, каталаза, пероксидаза, цитохромы. Функции гемопротеинов.
Фосфопротеины в качестве простетической группы содержат остаток фосфорной кислоты. Примеры: казеин и казеиноген молока, творога, молочных продуктов, вителлин яичного желтка, овальбумин яичного белка, ихтуллин икры рыб. Фосфопротеинами богаты клетки ЦНС. Фосфопротеины обладают многообразными функциями: 1. Питательная функция. Фосфопротеины молочных продуктов легко перевариваются, усваиваются и являются источником незаменимых аминокислот и фосфора для синтеза белков тканей ребенка. 2. Фосфорная кислота необходима для полноценного формирования нервной и костной тканей ребенка. 3. Фосфорная кислота участвует в синтезе фосфолипидов, фосфопротеинов, нуклеотидов, нуклеиновых кислот. 4. Фосфорная кислота осуществляет регуляцию активности ферментов путем фосфорилирования при участии ферментов протеинкиназ. Фосфат присоединяется к –ОН группе серина или треонина сложноэфирными связями:Хромопротеины - сложные белки с окрашенной небелковой частью. К ним относятся флавопротеины (желтые) и гемопротеины (красные). Флавопротеины в качестве простетической группы содержат производные витамина В2 – флавины: флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН). Они являются небелковой частью ферментов дегидрогеназ, катализирующих окислительно-восстановительные реакции. Гемопротеины в качестве небелковой группы содержат гем – железопорфириновый комплекс. Гемопротеины подразделяют на два класса: 1. ферменты: каталаза, пероксидаза, цитохромы; 2. неферменты: гемоглобин и миоглобин. Ферменты каталаза и пероксидаза разрушают перекись водорода, цитохромы являются переносчиками электронов в цепи переноса электронов. Неферменты. Гемоглобин транспортирует кислород (от легким к тканям) и углекислый газ (от тканей к легким); миоглобин – депо кислорода в работающей мышце. Гемоглобин – тетрамер, т.к. состоит из 4-х субъединиц: глобин в этом тетрамере представлен 4-мя полипептидными цепями 2-х разновидностей: 2 α и 2 β цепи. Каждая субъединица связана с гемом. Физиологические типы гемоглобина: 1. HbP – примитивный гемоглобин формируется у зародыша. 2. HbF – фетальный гемоглобин – гемоглобин плода. Замена HbP на HbF происходит к 3-х месячному возрасту человека.
9. Ферменты, история открытия и изучения ферментов, особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
Ферменты – биологические катализаторы белковой природы, образуемые живой клеткой, действующие с высокой активностью и специфичностью. Сходство ферментов с небиологическими катализаторами заключается в том, что:
- ферменты катализируют энергетически возможные реакции;
- энергия химической системы остаётся постоянной;
- в ходе катализа направление реакции не изменяется;
- ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
- скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
- ферменты обладают высокой специфичностью;
- ферментативная реакция проходит в клетке, т.е. при температуре 37 °С, постоянном атмосферном давлении и физиологическом значении рН;
- скорость ферментативной реакции может регулироваться.
Современная классификация ферментов основана на природе катализируемых ими химических превращений. В основу классификации берется тип реакции, катализируемой ферментом. Ферменты разделяют на 6 классов:
1. Оксидоредуктазы - катализируют окислительно-восстановительные реакции
2. Трансферазы – перенос групп
3. Гидролазы – гидролиз
4. Лиазы – негидролитическое расщепление субстрата
5. Изомеразы – изомеризация
6. Лигазы (синтетазы)- синтез с использованием энергии (АТФ)
Номенклатура ферментов.
1. Тривиальное название (пепсин, трипсин).
2. Название фермента может складываться из названия субстрата с прибавлением окончания «аза»
(аргиназа гидролизует аминокислоту аргинин).
3. Добавление окончания «аза» к названию катализируемой реакции (гидролаза катализирует
гидролиз, дегидрогеназа – дегидрирование органической молекулы, т.е. отнятие протонов и электронов от субстрата).
4. Рациональное название – название субстратов и характер катализируемых реакций (АТФ + гексоза
гексозо-6-фосфат + АДФ. Фермент: АТФ: D-гексоза-6-фосфотрансфераза).
номера): 1.1.1.1 – АДГ, 1.1.1.27 – ЛДГ.
Зависимость скорости ферментативной реакции от рН среды Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH 3 +), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО -). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному , совпадающий с физиологическим значением рН.
Зависимость скорости ферментативной реакции от температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Для большинства ферментов человека оптимальна температура 37-38 °С. Специфичность – очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра (стерическое совпадение). За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности:
Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу, лактаза – лактозу, мальтаза – мальтозу, уреаза – мочевину, аргиназа – аргинин и т.д.Относительная специфичность – это способность фермента действовать на группу субстратов с общим типом связи, т.е. относительная специфичность проявляется только по отношению к определенному типу связи в группе субстратов. Пример: липаза расщепляют сложноэфирную связь в жирах животного и растительного происхождения. Амилаза гидролизует α-гликозидную связь в крахмале, декстринах и гликогене. Алкогольдегидрогеназа окисляет спирты (метанол, этанол и др.). Стереохимическая специфичность – это способность фермента действовать только на один стереоизомер. Например: 1) α, β-изомерия: α – амилаза слюны и сока поджелудочной железы расщепляет только α-глюкозидные связи в крахмале и не расщепляет β-глюкозидные связи клетчатки. Международной единицей (МЕ) активности ферментов является количество фермента, способного превратить 1 мкмоль субстрата в продукты реакции за 1 мин при 25 °С и оптимуме рН. Катал соответствует количеству катализатора, способного превращать 1 моль субстрата в продукт за 1 сек при 25 °С и оптимуме рН. Удельная активность фермента – число единиц ферментативной активности фермента в расчете на 1 мг белка. Молярная активность – это отношение числа единиц ферментативной активности каталов или МЕ к числу молей фермента.
10. Строение ферментов. Структура и функции активного центра. Механизм действия ферментов. Кофакторы ферментов: ионы металлов и коферменты, их участие в работе ферментов. Активаторы ферментов: механизм действия. Ингибиторы ферментативных реакций: конкурентные, неконкурентные, необратимые. Лекарственные препараты – ингибиторы ферментов (примеры).
По строению ферменты могут быть:
1. однокомпонентные (простые белки),
2. двухкомпонентные (сложные белки).
К ферментам - простым белкам – относятся пищеварительные ферменты (пепсин, трипсин). К ферментам – сложным белкам – можно отнести ферменты, катализирующие окислительно - восстановительные реакции. Для каталитической активности двухкомпонентных ферментов необходим дополнительный химический компонент, который называется кофактор , их могут играть как неорганические вещества (ионы железа, магния, цинка, меди и др .), так и органические вещества – коферменты (например, активные формы витаминов ). Для работы ряда ферментов необходимы и кофермент, и ионы металлов (кофактор). Коферменты – низкомолекулярные органические вещества небелковой природы, связанные с белковой частью фермента временно и непрочно. В случае, когда небелковая часть фермента (кофермент) связана с белковой прочно и постоянно, то такую небелковую часть называют простетической группой . Белковая часть сложного белка-фермента называют апоферментом. Вместе апофермент и кофактор образуют холофермент .
В процессе ферментативного катализа, принимает участие не вся белковая молекула, а лишь определенный участок – активный центр фермента. Активный центр ферментов представляет часть молекулы фермента, к которой присоединяется субстрат и от которой зависят каталитические свойства молекулы фермента. В активном центре фермента выделяют «контактный» участок – участок, притягивающий и удерживающий субстрат на ферменте благодаря своим функциональным группам и «каталитический» участок , функциональные группы которого непосредственно участвуют в каталитической реакции. У некоторых ферментов, кроме активного центра, имеется еще «другой» центр – аллостерический. С аллостерическим центром взаимодействуют различные вещества (эффекторы), чаще всего различные метаболиты. Соединение этих веществ с аллостерическим центром приводит к изменению конформации фермента (третичной и четвертичной структуры). Активный центр в молекуле фермента либо создается, либо он нарушается. В первом случае реакция ускоряется, во втором случае тормозится. Поэтому аллостерический центр называют регуляторным центром фермента. Ферменты, имеющие в своей структуре аллостерический центр, называются регуляторными или аллостерическими .В основу теории механизма действия ферментов положено образование фермент-субстратного комплекса. Механизм действия фермента:
1. образование фермент-субстратного комплекса, субстрат прикрепляется к активному центру фермента.
2. на второй стадии ферментативного процесса, которая протекает медленно, происходят электронные перестройки в фермент-субстратном комплексе. Фермент (En) и субстрат (S) начинают сближаться, чтобы вступить в максимальный контакт и образовать единый фермент-субстратный комплекс. Продолжительность второй стадии зависит от энергии активации субстрата или энергетического барьера данной химической реакции. Энергия активации – энергия, необходимая для перевода всех молекул 1 моля S в активированное состояние при данной температуре. Для каждой химической реакции существует свой энергетический барьер. Благодаря образованию фермент-субстратного комплекса снижается энергия активации субстрата, реакция начинает протекать на более низком энергетическом уровне. Поэтому вторая стадия процесса лимитирует скорость всего катализа.
3. на третьей стадии происходит сама химическая реакция с образованием продуктов реакции. Третья стадия процесса непродолжительна. В результате реакции субстрат превращается в продукт реакции; фермент-субстратный комплекс распадается и фермент выходит неизмененным из ферментативной реакции. Таким образом, фермент дает возможность за счет образования фермент-субстратного комплекса проходить химической реакции обходным путем на более низком энергетическом уровне.
Кофактор - небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn 2+ , Mg 2+ , Mn 2+ , Fe 2+ , Cu 2+ , K + , Na +) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Роль кофактора в основном сводится к следующему:
- изменение третичной структуры белка и создание комплементарности между ферментом и субстратом;
- непосредственное участие в реакции в качестве еще одного субстрата.
Активаторами могут быть:
1) кофакторы, т.к. они важные участники ферментативного процесса. Например, металлы, входящие
в состав каталитического центра фермента: амилаза слюны активна в присутствии ионов Са, лактатдегидрогеназа (ЛДГ) – Zn, аргиназа – Mn, пептидаза – Mg и коферменты: витамин С, производные различных витаминов (НАД, НАДФ, ФМН, ФАД, КоАSH и др.). Они обеспечивают связывание активного центра фермента с субстратом.
2) анионы также могут оказывать активирующее влияние на активность фермента, например, анионы
Сl- активируют слюнную амилазу;
3) активаторами могут служить также вещества, создающие оптимальное значение рН среды для проявления ферментативной активности, например, НСl для создания оптимальной среды желудочного содержимого для активации пепсиногена в пепсин;
4) активаторами являются также вещества, переводящие проферменты в активный фермент, например, энтерокиназа кишечного сока активирует превращение трипсиногена в трипсин;
5) активаторами могут быть разнообразные метаболиты, которые связываются с аллостерическим центром фермента и способствуют формированию активного центра фермента.
 Ингибиторы
- это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования: необратимое и обратимое. При необратимом ингибировании - ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.). Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента. Классический пример, конкурентного ингибирование – торможение действия сукцинатдегидрогеназы малоновой кислотой
. Неконкурентные ингибиторы связываются с аллостерическим центром фермента. Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к деформации каталитического центра фермента и снижению ферментативной активности. Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма. Лекарственные свойства ингибиторов ферментов (Контрикал, Трасилол, Аминокапроновая кислота, Памба). Контрикал (апротинин) применяют для лечения острого панкреатита и обострения хронического панкреатита, острого панкреонекроза, острых кровотечений.
Ингибиторы
- это вещества, которые тормозят активность ферментов. Различают два основных типа ингибирования: необратимое и обратимое. При необратимом ингибировании - ингибитор прочно (необратимо) связывается с активным центром фермента ковалентными связями, изменяет конформацию фермента. Таким образом, могут действовать на ферменты соли тяжелых металлов (ртути, свинца, кадмия и др.). Обратимое ингибирование - это такой тип ингибирования, когда активность ферментов может восстанавливаться. Обратимое ингибирование бывает 2-х типов: конкурентное и неконкурентное. При конкурентном ингибировании обычно субстрат и ингибитор очень похож по химическому строению. При этом виде ингибирования субстрат (S) и ингибитор (I) одинаково могут связываться с активным центром фермента. Они конкурируют друг с другом за место в активном центре фермента. Классический пример, конкурентного ингибирование – торможение действия сукцинатдегидрогеназы малоновой кислотой
. Неконкурентные ингибиторы связываются с аллостерическим центром фермента. Вследствие этого происходят изменения конформации аллостерического центра, которые приводят к деформации каталитического центра фермента и снижению ферментативной активности. Часто аллостерическими неконкурентными ингибиторами выступают продукты метаболизма. Лекарственные свойства ингибиторов ферментов (Контрикал, Трасилол, Аминокапроновая кислота, Памба). Контрикал (апротинин) применяют для лечения острого панкреатита и обострения хронического панкреатита, острого панкреонекроза, острых кровотечений.
Регуляция действия ферментов. Аллостерический центр, аллостерические ингибиторы и активаторы (примеры). Регуляция активности ферментов путем фосфорилирования и дефосфорилирования (примеры). Виды гормональной регуляции активности ферментов.
12. Различия ферментов состава органов и тканей. Органоспецифические ферменты, изоферменты (на примере ЛДГ, МДГ и др.). Изменения активности ферментов при патологии. Энзимопатии, энзимодиагностика и энзимотерапия.
Изоферменты - это различные по аминокислотной последовательности изоформы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам. Примером фермента, имеющего изоферменты, является амилаза - панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Это послужило основой для разработки и применения более надёжного метода диагностики острого панкреатита путём определения не общей амилазы плазмы крови, а именно панкреатической изоамилазы.Энзимопатии – заболевания, вызванные нарушением синтеза ферментов:
а) в полном или частичном отсутствии ферментативной активности;
б) в чрезмерном усилении ферментативной активности;
в) в продукции патологических ферментов, которые не встречаются у здорового человека.
Различают наследственные и приобретенные энзимопатии. Наследственные энзимопатии связаны с нарушением в генетическом аппарате клетки, приводящим к отсутствию синтеза определенных ферментов. К наследственным заболеваниям относятся энзимопатии, связанные с нарушением превращения аминокислот:
1. Фенилкетонурия – наследственное нарушение синтеза фермента фенилаланингидроксилазы, при участии которого происходит превращение фенилаланина в тирозин. При этой патологии происходит увеличение концентрации в крови фенилаланина. При этом заболевании у детей необходимо исключить из рациона фенилаланин.
2. Альбинизм – заболевание, связанное с генетическим дефектом фермента тирозиназы. При потере меланоцитами способности синтезировать этот фермент (окисляет тирозин в ДОФА и ДОФА-хинон) в коже, волосах и сетчатке глаза не образуется меланин.
Приобретенные энзимопатии , т.е. нарушение синтеза ферментов, могут возникать в результате:
1. длительного применения лекарств (антибиотиков, сульфаниламидов);
2. перенесенных инфекционных заболеваний;
3. вследствие авитаминозов;
4. злокачественных опухолей.
Энзимодиагностика определение активности ферментов для диагностики заболеваний. Ферменты плазмы крови делят на 3 группы: секреторные, индикаторные и экскреторные. Индикаторные – клеточные ферменты. При заболеваниях, сопровождающихся повреждением клеточных мембран, эти ферменты в большом количестве появляются в крови, свидетельствуя о патологии в определенных тканях. Например, активность амилазы в крови и моче увеличивается при острых панкреатитах. Для энзимодиагностики проводят определение изоферментов. При патологических состояниях выход фермента в кровь может усилиться в связи с изменением состояния мембраны клетки. Исследование активности ферментов крови и других биологических жидкостях широко применяется с целью диагностики заболеваний. Например, диастаза мочи и амилаза крови при панкреатитах (повышение активности), понижение активности амилазы – при хроническом панкреатите.
Энзимотерапия – применение ферментов в качестве лекарственных препаратов. Например, смесь ферментативных препаратов пепсина, трипсина, амилазы (панкреатин, фестал) используют при заболеваниях ЖКТ с пониженной секрецией, трипсин и химотрипсин – используются в хирургическойпрактике при гнойных заболеваниях для гидролиза бактериальных белков.
13. Энзимопатия у детей и важность их биохимической диагностики (на примере нарушения азотистого и углеводного обмена).
Наиболее распространённый вариант энзимопатий, приводящий к развитию гемолитической анемии - недостаточность глюкозо6фосфат дегидрогеназы. Рассмотрим причины энзимопатий у детей. Заболевание широко распространено среди афроамериканцев (630%), меньше - среди татар (3,3%), народностей Дагестана (511,3%); в русской популяции выявляют редко (0,4%). Частный случай недостаточности глюкозо6фосфат дегидрогеназы - фавизм. Гемолиз развивается при употреблении в пищу конских бобов, фасоли, гороха, вдыхании нафталиновой пыли. Причины энзимопатий у детей Наследование недостаточности глюкозо6фосфат дегидрогеназы (N), в силу чего чаще болеют мужчины. В мире насчитывают около 400 млн носителей этого патологического гена. Заболевание развивается, как правило, после приёма определённых лекарственных средств [производные нитрофурана, хинин, изониазид, фтивазид, аминосалициловая кислота (натрия парааминосалицилат), налидиксовая кислота, сульфаниламиды и др.] или на фоне инфекции. Энзимопатии у детей – признаки. Заболевание проявляется бурным развитием гемолиза при употреблении перечисленных выше веществ или инфекциях (особенно при пневмониях, брюшном тифе, гепатите). Недостаточность глкжозо6фосфат дегидрогеназы может быть причиной желтухи новорождённых. В анализе крови выявляют ретикулоцитоз, повышение уровня прямого и непрямого билирубина, ЛДГ, щелочной фосфатазы. Морфология эритроцитов и эритроцитарные индексы не изменены. Диагноз устанавливают на основании результатов определения активности фермента. Энзимопатии у детей – лечение. Вне криза лечение не проводят. При лихорадке применяют физические методы охлаждения. При хроническом гемолизе назначают фолиевую кислоту 1 мт/сут по 3 нед каждые 3 мес. При кризе отменяют все лекарственные средства, проводят инфузионную терапию на фоне дегидратации.
14. Витамины, классификация витаминов (по растворимость и функциональная). История открытия и изучения витаминов.
Витамины - низкомолекулярные органические соединения различной химической природы и различного строения, синтезируемые главным образом растениями, частично - микроорганизмами.
Для человека витамины - незаменимые пищевые факторы. Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
А. Водорастворимые:
- Витамин В 1 (тиамин);
- Витамин В 2 (рибофлавин);
- Витамин РР (никотиновая кислота, никотинамид, витамин В 3);
- Пантотеновая кислота (витамин В 5);
- Витамин В 6 (пиридоксин);
- Биотин (витамин Н);
- Фолиевая кислота (витамин В с, В 9);
- Витамин В 12 (кобаламин);
- Витамин С (аскорбиновая кислота);
- Витамин Р (биофлавоноиды).
Б. Жирорастворимые
- Витамин А (ретинол);
- Витамин D (холекальциферол);
- Витамин Е (токоферол);
- Витамин К (филлохинон).
15. Витамин А, структура, участие в обменных процессах. Гипо- гипер- и авитаминоз А, их причины и особенности проявления. Пищевые источники, суточная потребность.
 Витамин А (ретинол)
-
циклический, ненасыщенный, одноатомный спирт. Витамин А содержится только в животных продуктах: печени крупного рогатого скота и свиней, яичном желтке, молочных продуктах; особенно богат этим витамином рыбий жир. Суточная потребность
витамина А взрослого человека составляет от 1 до 2,5 мг витамина. Биологические функции витамина А.
В организме ретинол превращается в ретиналь и ретиноевую кислоту, участвующие в регуляции ряда функций (в росте и дифференцировке клеток); они также составляют фотохимическую основу акта зрения. Основные клинические проявления гиповитаминоза А.
Наиболее ранний и характерный признак недостаточности витамина А у людей - нарушение сумеречного зрения (гемералопия, или "куриная" слепота). Специфично для авитаминоза А поражение глазного яблока - ксерофтальмия, т.е. развитие сухости роговой оболочки глаза как следствие закупорки слёзного канала в связи с ороговением эпителия. Это, в свою очередь, приводит к развитию конъюнктивита, отёку, изъязвлению и размягчению роговой оболочки, т.е. к кератомаляции. Ксерофтальмия и кератомаляция при отсутствии соответствующего лечения могут привести к полной потере зрения.
Витамин А (ретинол)
-
циклический, ненасыщенный, одноатомный спирт. Витамин А содержится только в животных продуктах: печени крупного рогатого скота и свиней, яичном желтке, молочных продуктах; особенно богат этим витамином рыбий жир. Суточная потребность
витамина А взрослого человека составляет от 1 до 2,5 мг витамина. Биологические функции витамина А.
В организме ретинол превращается в ретиналь и ретиноевую кислоту, участвующие в регуляции ряда функций (в росте и дифференцировке клеток); они также составляют фотохимическую основу акта зрения. Основные клинические проявления гиповитаминоза А.
Наиболее ранний и характерный признак недостаточности витамина А у людей - нарушение сумеречного зрения (гемералопия, или "куриная" слепота). Специфично для авитаминоза А поражение глазного яблока - ксерофтальмия, т.е. развитие сухости роговой оболочки глаза как следствие закупорки слёзного канала в связи с ороговением эпителия. Это, в свою очередь, приводит к развитию конъюнктивита, отёку, изъязвлению и размягчению роговой оболочки, т.е. к кератомаляции. Ксерофтальмия и кератомаляция при отсутствии соответствующего лечения могут привести к полной потере зрения.
16. Витамин Д, структура, участие в обменных процессах. Активные формы витамина Д в организме. Гипер-, гипо- и авитаминоз Д. Пищевые источники, суточная потребность.Роль витамина Д как антирахитического фактора. Биохимическая сущность рахита.
 Витамины группы D (кальциферолы)
- группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D 2 и D 3 . Витамин D 2 (эргокалферол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. Источники
.
Наибольшее количество витамина D 3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире. Суточная потребность
для детей 12-25 мкг (500-1000 ME), для взрослого человека потребность значительно меньше. Биологическая роль
.
В организме человека витамин D 3 гидроксилируется в положениях 25 и 1 и превращается в биологически активное соединение 1,25-дигидроксихолекальциферол. Кальцитриол выполняет гормональную функцию, участвуя в регуляции обмена Са 2+ и фосфатов, стимулируя всасывание Са 2+ в кишечнике и кальцификацию костной ткани, реабсорбцию Са 2+ и фосфатов в почках. Недостаточность
.
При недостатке витамина D у детей развивается заболевание "рахит", характеризуемое нарушением кальцификации растущих костей. При этом наблюдают деформацию скелета с характерными изменениями. Избыток
.
Поступление в организм избыточного количества витамина D 3 может вызвать гипервитаминоз D. Это состояние характеризуется избыточным отложением солей кальция в тканях лёгких, почек, сердца, стенках сосудов, а также остеопорозом с частыми переломами костей.
Витамины группы D (кальциферолы)
- группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D 2 и D 3 . Витамин D 2 (эргокалферол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. Источники
.
Наибольшее количество витамина D 3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире. Суточная потребность
для детей 12-25 мкг (500-1000 ME), для взрослого человека потребность значительно меньше. Биологическая роль
.
В организме человека витамин D 3 гидроксилируется в положениях 25 и 1 и превращается в биологически активное соединение 1,25-дигидроксихолекальциферол. Кальцитриол выполняет гормональную функцию, участвуя в регуляции обмена Са 2+ и фосфатов, стимулируя всасывание Са 2+ в кишечнике и кальцификацию костной ткани, реабсорбцию Са 2+ и фосфатов в почках. Недостаточность
.
При недостатке витамина D у детей развивается заболевание "рахит", характеризуемое нарушением кальцификации растущих костей. При этом наблюдают деформацию скелета с характерными изменениями. Избыток
.
Поступление в организм избыточного количества витамина D 3 может вызвать гипервитаминоз D. Это состояние характеризуется избыточным отложением солей кальция в тканях лёгких, почек, сердца, стенках сосудов, а также остеопорозом с частыми переломами костей.
17. Витамин РР, структура коферментов, участие в обменных процессах. Гипо- и авитаминоз РР. Пищевые источники, суточная потребность.
 Витамин РР (никотиновая кислота, никотинамид, витамин B 3
) Источники
.
Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Суточная потребность
в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг. Биологические функции.
Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ. Недостаточность витамина РР
приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
Витамин РР (никотиновая кислота, никотинамид, витамин B 3
) Источники
.
Витамин РР широко распространён в растительных продуктах, высоко его содержание в рисовых и пшеничных отрубях, дрожжах, много витамина в печени и почках крупного рогатого скота и свиней. Суточная потребность
в этом витамине доставляет для взрослых 15-25 мг, для детей - 15 мг. Биологические функции.
Никотиновая кислота в организме входит в состав NAD и NADP, выполняющих функции коферментов различных дегидрогеназ. Недостаточность витамина РР
приводит к заболеванию "пеллагра", для которого характерны 3 основных признака: дерматит, диарея, деменция ("три Д"), Пеллагра проявляется в виде симметричного дерматита на участках кожи, доступных действию солнечных лучей, расстройств ЖКТ (диарея) и воспалительных поражений слизистых оболочек рта и языка. В далеко зашедших случаях пеллагры наблюдают расстройства ЦНС (деменция): потеря памяти, галлюцинации и бред.
18. Витамин В 2 , структура коферментов, участие в обменных процессах. Гиповитаминоз и авитаминоз В 2 . Суточная потребность, пищевые источники.
 Витамин В 2 (рибофлавин).
В основе структуры витамина В 2 лежит структура изоаллоксазина, соединённого со спиртом рибитолом. Главные источники
витамина В 2 - печень, почки, яйца, молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек получает витамин В 2 как продукт жизнедеятельности кишечной микрофлоры. Суточная потребность
в витамине В 2 взрослого человека составляет 1,8-2,6 мг. Биологические функции.
В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD. Клинические проявления недостаточности
рибофлавина выражаются в остановке роста у молодых организмов. Часто развиваются воспалительные процессы на слизистой оболочке ротовой полости, появляются длительно незаживающие трещины в углах рта, дерматит носогубной складки. Типично воспаление глаз: конъюнктивиты, васкуляризация роговицы, катаракта. Кроме того, при авитаминозе В 2 развиваются общая мышечная слабость и слабость сердечной мышцы.
Витамин В 2 (рибофлавин).
В основе структуры витамина В 2 лежит структура изоаллоксазина, соединённого со спиртом рибитолом. Главные источники
витамина В 2 - печень, почки, яйца, молоко, дрожжи. Витамин содержится также в шпинате, пшенице, ржи. Частично человек получает витамин В 2 как продукт жизнедеятельности кишечной микрофлоры. Суточная потребность
в витамине В 2 взрослого человека составляет 1,8-2,6 мг. Биологические функции.
В слизистой оболочке кишечника после всасывания витамина происходит образование коферментов FMN и FAD. Клинические проявления недостаточности
рибофлавина выражаются в остановке роста у молодых организмов. Часто развиваются воспалительные процессы на слизистой оболочке ротовой полости, появляются длительно незаживающие трещины в углах рта, дерматит носогубной складки. Типично воспаление глаз: конъюнктивиты, васкуляризация роговицы, катаракта. Кроме того, при авитаминозе В 2 развиваются общая мышечная слабость и слабость сердечной мышцы.
19. Витамин С, структура, участие в обменных процессах. Гипо- и авитаминоз С. Пищевые источники, суточная потребность.
 Витамин С (аскорбиновая кислота)
. Источники
витамина С - свежие фрукты, овощи, зелень. Суточная потребность
человека в витамине С составляет 50-75 мг. Биологические функции.
Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты. Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксид-анион радикал до перекиси водорода. Клинические проявления недостаточности витамина
С.
Недостаточность аскорбиновой кислоты приводит к заболеванию, называемому цингой (скорбут). Цинга, возникающая у человека при недостаточном содержании в пищевом рационе свежих фруктов и овощей, описана более 300 лет назад, со времени проведения длительных морских плаваний и северных экспедиций. Это заболевание связано с недостатком в пище витамина С. Болеют цингой только человек, приматы и морские свинки. Главные проявления авитаминоза обусловлены в основном нарушением образования коллагена в соединительной ткани. Вследствие этого наблюдают разрыхление дёсен, расшатывание зубов, нарушение целостности капилляров (сопровождающееся подкожными кровоизлияниями). Возникают отёки, боль в суставах, анемия.
Витамин С (аскорбиновая кислота)
. Источники
витамина С - свежие фрукты, овощи, зелень. Суточная потребность
человека в витамине С составляет 50-75 мг. Биологические функции.
Образование коллагена, серотонина из триптофана, образование катехоламинов, синтез кортикостероидов. Аскорбиновая кислота также участвует в превращении холестерина в желчные кислоты. Витамин С необходим для детоксикации в гепатоцитах при участии цитохрома P450. Витамин С сам нейтрализует супероксид-анион радикал до перекиси водорода. Клинические проявления недостаточности витамина
С.
Недостаточность аскорбиновой кислоты приводит к заболеванию, называемому цингой (скорбут). Цинга, возникающая у человека при недостаточном содержании в пищевом рационе свежих фруктов и овощей, описана более 300 лет назад, со времени проведения длительных морских плаваний и северных экспедиций. Это заболевание связано с недостатком в пище витамина С. Болеют цингой только человек, приматы и морские свинки. Главные проявления авитаминоза обусловлены в основном нарушением образования коллагена в соединительной ткани. Вследствие этого наблюдают разрыхление дёсен, расшатывание зубов, нарушение целостности капилляров (сопровождающееся подкожными кровоизлияниями). Возникают отёки, боль в суставах, анемия.
20. Витамин В 1 , структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз В 1 . Пищевые источники, суточная потребность.
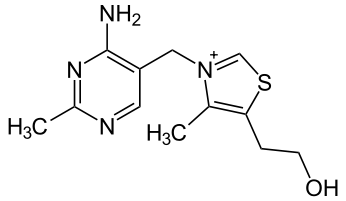 Витамин B 1 (тиамин).
Структура витамина включает пиримидиновое и тиазоловое кольца, соединённые метановым мостиком. Источники
.
Он широко распространён в продуктах растительного происхождения (оболочка семян хлебных злаков и риса, горох, фасоль, соя и др.). Суточная потребность
взрослого человека в среднем составляет 2-3 мг витамина В 1 . Биологическая роль
витамина В, определяется тем, что в виде ТДФ он входит в состав как минимум трёх ферментов и ферментных комплексов: в составе пируват - и оскетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбоксилировании пирувата и оскетоглутарата; в составе транскетолазы ТДФ участвует в пентозофосфатном пути превращения углеводов. Основной, наиболее характерный и специфический признак недостаточности витамина В 1
- полиневрит, в основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных стволов, затем - потеря кожной чувствительности и наступает паралич (бери-бери). Второй важнейший признак заболевания - нарушение сердечной деятельности, что выражается в нарушении сердечного ритма, увеличении размеров сердца и в появлении болей в области сердца. К характерным признакам заболевания, связанного с недостаточностью витамина В 1 относят также нарушения секреторной и моторной функций ЖКТ; наблюдают снижение кислотности желудочного сока, потерю аппетита, атонию кишечника.
Витамин B 1 (тиамин).
Структура витамина включает пиримидиновое и тиазоловое кольца, соединённые метановым мостиком. Источники
.
Он широко распространён в продуктах растительного происхождения (оболочка семян хлебных злаков и риса, горох, фасоль, соя и др.). Суточная потребность
взрослого человека в среднем составляет 2-3 мг витамина В 1 . Биологическая роль
витамина В, определяется тем, что в виде ТДФ он входит в состав как минимум трёх ферментов и ферментных комплексов: в составе пируват - и оскетоглутаратдегидрогеназных комплексов он участвует в окислительном декарбоксилировании пирувата и оскетоглутарата; в составе транскетолазы ТДФ участвует в пентозофосфатном пути превращения углеводов. Основной, наиболее характерный и специфический признак недостаточности витамина В 1
- полиневрит, в основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных стволов, затем - потеря кожной чувствительности и наступает паралич (бери-бери). Второй важнейший признак заболевания - нарушение сердечной деятельности, что выражается в нарушении сердечного ритма, увеличении размеров сердца и в появлении болей в области сердца. К характерным признакам заболевания, связанного с недостаточностью витамина В 1 относят также нарушения секреторной и моторной функций ЖКТ; наблюдают снижение кислотности желудочного сока, потерю аппетита, атонию кишечника.
21. Витамин В 6 , структура кофермента, участие в обменных процессах. Гиповитаминоз и авитаминоз В 6 . Пищевые источники, суточная потребность.
ВитаминВ 6 (пиридоксин, пиридоксаль, пиридоксамин)
В основе структуры витамина В 6 лежит пиридиновое кольцо. Известны 3 формы витамина В 6 , отличающиеся строением замещающей группы у атома углерода в п-положении к атому азота. Все они характеризуются одинаковой биологической активностью.  Источники витамина В 6
для человека - такие продукты питания, как яйца, печень, молоко, зеленый перец, морковь, пшеница, дрожжи. Некоторое количество витамина синтезируется кишечной флорой. Суточная потребностьсоставляет 2-3 мг. Биологические функции.Все формы витамина В6 используются в организме для синтеза коферментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фосфорилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата. Клинические проявления недостаточности витамина.
Авитаминоз В 6 у детей проявляется повышенной возбудимостью ЦНС, периодическими судорогами, что связано, возможно, с недостаточным образованием тормозного медиатора ГАМК, специфическими дерматитами. У взрослых признаки гиповитаминоза В 6 наблюдают при длительном лечении туберкулёза изониазидом (антагонист витамина В 6). При этом возникают поражения нервной системы (полиневриты), дерматиты.
Источники витамина В 6
для человека - такие продукты питания, как яйца, печень, молоко, зеленый перец, морковь, пшеница, дрожжи. Некоторое количество витамина синтезируется кишечной флорой. Суточная потребностьсоставляет 2-3 мг. Биологические функции.Все формы витамина В6 используются в организме для синтеза коферментов: пиридоксальфосфата и пиридоксаминфосфата. Коферменты образуются путём фосфорилирования по гидроксиметильной группе в пятом положении пиримидинового кольца при участии фермента пиридоксалькиназы и АТФ как источника фосфата. Клинические проявления недостаточности витамина.
Авитаминоз В 6 у детей проявляется повышенной возбудимостью ЦНС, периодическими судорогами, что связано, возможно, с недостаточным образованием тормозного медиатора ГАМК, специфическими дерматитами. У взрослых признаки гиповитаминоза В 6 наблюдают при длительном лечении туберкулёза изониазидом (антагонист витамина В 6). При этом возникают поражения нервной системы (полиневриты), дерматиты.
22. Пантотеновая кислота и биотин, их участие в обменных процессах. Гиповитаминозы и авитаминозы В 3 и Н. Суточная потребность, источник этих витаминов.
Пантотеновая кислота (лекарственная форма - пантотенат кальция, витамин B 5 , неверное обозначение - витамин B 3). Пантотеновая кислота требуется для обмена жиров, углеводов, аминокислот, синтеза жизненно важных жирных кислот, холестерина, гистамина, ацетилхолина, гемоглобина. Пантотеновая кислота чувствительна к нагреванию, при термической обработке теряется почти 50 % витамина. Суточная потребность человека в пантотеновой кислоте (5-10 мг) удовлетворяется при нормальном смешанном питании, так как пантотеновая кислота содержится в очень многих продуктах животного и растительного происхождения (дрожжи, икра рыб, яичный желток, зелёные части растений, молоко, морковь, капуста и т. д.).Симптомы гиповитаминоза : 1.усталость 2.депрессия 3.расстройство сна 4.повышенная утомляемость 5.головные боли 6. Тошнота 7. мышечные боли
23. Фолиевая кислота и кобаламин, их участие в обменных процессах, авитаминозы. Пищевые источники, суточная потребность.
Фолиевая кислота (витамин В c , витамин B 9) . Источники . Значительное количество этого витамина содержится в дрожжах, а также в печени, почках, мясе и других продуктах животного происхождения. Суточная потребность в фолиевой кислоте колеблется от 50 до 200 мкг; однако вследствие плохой всасываемости этого витамина рекомендуемая суточная доза - 400 мкг. Биологическая роль фолиевой кислоты определяется тем, что она служит субстратом для синтеза коферментов, участвующих в реакциях переноса одноуглеродных радикалов различной степени окисленности: метальных, оксиметильных, формильных и других. Эти коферменты участвуют в синтезе различных веществ: пуриновых нуклеотидов, превращении сУМФ в сПГМФ, в обмене глицина и серина. Наиболее характерные признаки авитаминоза фолиевой кислоты - нарушение кроветворения и связанные с этим различные формы малокровия (макроцитарная анемия), лейкопения и задержка роста. При гиповитаминозе фолиевой кислоты наблюдают нарушения регенерации эпителия, особенно в ЖКТ. Витамин В 12 (кобаламин). Источники . Это единственный витамин, синтезируемый почти исключительно микроорганизмами: бактериями, актиномицетами и сине-зелёными водорослями. Из животных тканей наиболее богаты витамином В 12 печень и почки. Суточная потребность в витамине В 12 крайне мала и составляет всего 1-2 мкг. Биологическая роль. Витамин В 12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях. Основной признак авитаминоза В 12 - макроцитарная (мегалобластная) анемия. Для этого заболевания характерны увеличение размеров эритроцитов, снижение количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови. Нарушение кроветворения связано в первую очередь с нарушением обмена нуклеиновых кислот, в частности синтеза ДНК в быстроделящихся клетках кроветворной системы.
24. Витамин Е и К, участие их в обменных процессах. Гиповитаминозы и авитаминозы этих витаминов. Пищевые источники, суточная потребность.
Витамины группы Е (токоферолы) найдены в природных источниках. Все они - метальные производные исходного соединения токола, по строению очень близки и обозначаются буквами греческого алфавита. Наибольшую биологическую активность проявляет α-токоферол.Источники витамина Е для человека - растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток. Суточная потребность взрослого человека в витамине примерно 5 мг. Биологическая роль. По механизму действия токоферол является биологическим антиоксидантом. Он ингибирует свободнорадикальные реакции. Клинические проявления недостаточностивитамина Е. Дефицит витамина Е проявляется развитием гемолитической анемии.
 Витамины К (нафтохиноны)
существует в нескольких формах в растениях как филлохинон (К 1), клетках кишечной флоры как менахинон (К 2). Источники витамина К
-
растительные (капуста, шпинат, корнеплоды и фрукты) и животные (печень) продукты. Суточная потребность
в витамине взрослого составляет 1-2 мг. Биологическая функция витамина К
связана с его участием в процессе свёртывания крови. Он участвует в активации факторов свёртывания крови. Витамин К участвует в реакциях карбоксилирования в качестве кофермента. Основное проявление авитаминоза К
-
сильное кровотечение, часто приводящее к шоку и гибели организма.
Витамины К (нафтохиноны)
существует в нескольких формах в растениях как филлохинон (К 1), клетках кишечной флоры как менахинон (К 2). Источники витамина К
-
растительные (капуста, шпинат, корнеплоды и фрукты) и животные (печень) продукты. Суточная потребность
в витамине взрослого составляет 1-2 мг. Биологическая функция витамина К
связана с его участием в процессе свёртывания крови. Он участвует в активации факторов свёртывания крови. Витамин К участвует в реакциях карбоксилирования в качестве кофермента. Основное проявление авитаминоза К
-
сильное кровотечение, часто приводящее к шоку и гибели организма.
25. Возрастные потребности в отдельных витаминах у ребенка. Особенности проявления гипо- и авитаминозов в раннем детском возрасте.
Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность.
Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма.Основные причины гиповитаминозов:
- Недостаток витаминов в пище;
- Нарушение всасывания в ЖКТ;
- Врождённые дефекты ферментов, участвующих в превращениях витаминов;
- Действие структурных аналогов витаминов (антивитамины).
 Авитаминоз
- заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины.
Авитаминоз
- заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины.
Признаки авитаминоза:
§ шелушение кожного покрова.
§ ломкость ногтей.
§ выпадение волос.
§ умственная отсталость.
Причины, вызывающие авитаминоз:
§ Нарушение поступления витаминов с пищей при неправильном питании, недостаточном или некачественном питании.
§ Нарушение процессов пищеварения или нарушение работы органов, связанных непосредственно с пищеварением.
§ Поступление в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови.
§ Особенности детского обмена веществ
§ Особенности обмена веществ у пожилых людей
Некоторые заболевания:
§ цинга - при отсутствии витамина С
§ куриная слепота - Витамин А
§ бери-бери - Витамин B1
§ рахит - Витамин D
26. Гормоны – регуляторы обменных процессов в организме. Общие биологические признаки гормонов. Классификация по их химической структуре. механизм действия гормонов. Гормоны проникающего действия и непроникающего. Циклические посредники, их роль в регуляции гормонального эффекта. Аденилатциклазная система. Роль кальция, инозилтрифосфата в передаче гормонального сигнала.
Гормоны – вещества органической природы, вырабатывающиеся в специализированных клетках желез внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен веществ и физиологические функции.
В это определение необходимо внести соответствующие коррективы в связи с обнаружением типичных гормонов млекопитающих у одноклеточных (например, инсулин у микроорганизмов) или возможностью синтеза гормонов соматическими клетками в культуре ткани (например, лимфоцитами под действием факторов роста). Гормоны классифицируют в зависимости от места их природного синтеза, в соответствии с которым различают гормоны гипоталамуса, гипофиза, щитовидной железы, надпочечников, поджелудочной железы, половых желез, зобной железы и др. Современная классификация гормонов, основанной на их химической природе. В соответствии с этой классификацией различают три группы истинных гормонов:
1) пептидные и белковые гормоны,
2) гормоны – производные аминокислот
3) гормоны стероидной природы.
Четвертую группу составляют эйкозаноиды – гормоноподобные вещества, оказывающие местное действие.
Пептидные и белковые гормоны
включают от 3 до 250 и более аминокислотных остатков. Это гормоны гипоталамуса и гипофиза (тиролиберин, соматолиберин, соматостатин, гормон роста, кортикотропин, тиреотропин
), а также гормоны поджелудочной железы (инсулин, глюкагон). Гормоны – производные амино
кислот в основном представлены производными аминокислоты тирозина. Это низкомолекулярные соединения адреналин и норадреналин
, синтезирующиеся в мозговом веществе надпочечников, и гормоны щитовидной железы (тироксин
и его производные). Гормоны 1-й и 2-й групп хорошо растворимы в воде. Гормоны стероидной природы
представлены жирорастворимыми гормонами коркового вещества надпочечников (кортикостероиды), половыми гормонами (эстрогены и андрогены), а также гормональной формой витамина D.Эйкозаноиды
, являющиеся производными полиненасыщенной жирной кислоты (арахидоновой), представлены тремя подклассами соединений: простагландины, тромбоксаны и лейкотриены. Эти нерастворимые в воде и нестабильные соединения оказывают свое действие на клетки, находящиеся вблизи их места синтеза.  Гормоны первого типа связываются поверхностными рецепторами, расположенными на плазматической мембране. Различают три вида взаимодействия гормонов с плазматической мембраной. При взаимодействии первого вида
гормонрецепторный комплекс, находящийся на поверхности клеток, вызывает образование так называемого второго посредника - циклического аденозин-3,5-монофосфата (цАМФ
), и последующие действия гормона опосредуются цАМФ. Этот механизм характерен для некоторых белковых гормонов и биогенных аминов. При взаимодействии второго вида
рецептор клеточной поверхности индуцирует продукцию или высвобождение иных вторых посредников, например кальция.
Этот механизм характерен для некоторых нейротрансмиттеров и РТГ. При взаимодействии третьего вида
комплекс поверхностный рецептор - гормон интернализуется внутрь клетки. К последней категории гормонов относится инсулин.Некоторые гормоны, такие как стероидные гормоны
и гормоны щитовидной железы
, по свойствам являются гидрофобными
. В плазме крови для их транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются другими белками, которые уже являются рецепторами
. Комплекс гормон-рецептор
в некоторых случаях дополнительно модифицируется
и активируется
. Далее он проникает в ядро, где может связываться сядерным рецептором
. В результате гормон приобретает сродство к ДНК
. Связываясь с гормон-чувствительным элементом
в ДНК, гормон влияет на транскрипцию определенных генов и изменяет концентрацию РНК в клетке и, соответственно, количество определенных белков в клетке.
Гормоны первого типа связываются поверхностными рецепторами, расположенными на плазматической мембране. Различают три вида взаимодействия гормонов с плазматической мембраной. При взаимодействии первого вида
гормонрецепторный комплекс, находящийся на поверхности клеток, вызывает образование так называемого второго посредника - циклического аденозин-3,5-монофосфата (цАМФ
), и последующие действия гормона опосредуются цАМФ. Этот механизм характерен для некоторых белковых гормонов и биогенных аминов. При взаимодействии второго вида
рецептор клеточной поверхности индуцирует продукцию или высвобождение иных вторых посредников, например кальция.
Этот механизм характерен для некоторых нейротрансмиттеров и РТГ. При взаимодействии третьего вида
комплекс поверхностный рецептор - гормон интернализуется внутрь клетки. К последней категории гормонов относится инсулин.Некоторые гормоны, такие как стероидные гормоны
и гормоны щитовидной железы
, по свойствам являются гидрофобными
. В плазме крови для их транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются другими белками, которые уже являются рецепторами
. Комплекс гормон-рецептор
в некоторых случаях дополнительно модифицируется
и активируется
. Далее он проникает в ядро, где может связываться сядерным рецептором
. В результате гормон приобретает сродство к ДНК
. Связываясь с гормон-чувствительным элементом
в ДНК, гормон влияет на транскрипцию определенных генов и изменяет концентрацию РНК в клетке и, соответственно, количество определенных белков в клетке.
27. Гормоны гипоталамуса – либерины и статины. Химическая природа. Механизм их действия на молекулярном уровне, биологический эффект.
Гипоталамус служит местом непосредственного взаимодействия высших отделов ЦНС и эндокринной системы. гипоталамуса были выделены первые гуморальные факторы, оказавшиеся гормональными веществами с чрезвычайно высокой биологической активностью. Эти вещества получили наименование рилизинг-факторов
или либеринов. Вещества с противоположным действием, гипофизарных гормонов, стали называть ингибирующими факторами, или статинами. Таким образом, гормонам гипоталамуса принадлежит ключевая роль в физиологической системе гормональной регуляции многосторонних биологических функций отдельных органов, тканей и целостного организма. К настоящему времени в гипоталамусе открыто 7 стимуляторов (либерины) и 3 ингибитора (статины) секреции гормонов гипофиза, а именно: кортиколиберин, тиролиберин, люлиберин, фоллилиберин, соматолиберин, пролактолиберин, меланолиберин, соматостатин, пролактостатин и меланостатин. Установлено, что по химическому строению все гормоны гипоталамуса являются низкомолекулярными пептидами, так называемыми олигопептидами необычного строения, хотя точный аминокислотный состав и первичная структура выяснены не для всех.1.Тиролиберин
(Пиро-Глу–Гис–Про–NH2): представлен трипептидом, состоящим из пироглутаминовой(циклической) кислоты, гистидина и пролинамида, соединенных пептидными связями. В отличие от классических пептидов он не содержит свободных NH2- и СООН-групп у N- и С-концевых аминокислот.Ответственен за выпуск гормона, стимулирующего работу щитовидной железы.
2. Гонадолиберин
является декапептидом, состоящим из 10 аминокислотв последовательности: Пиро-Глу–Гис–Трп–Сер–Тир–Гли–Лей–Арг–Про–Гли-NН2. Концевая С-аминокислота представлена глицинамидом.ГнРГ вызывает усиление секреции передней долей гипофиза гонадотропных гормонов -лютеинизирующего гормона и фолликулостимулирующего гормона.
3. Соматостатин
является циклическим тетрадекапептидом (состоит из14 аминокислотных остатков). Отличается этот гормон от двух предыдущих, помимо циклической структуры, тем, что не содержит на N-конце пироглутаминовой кислоты: дисульфидная связь образуется между двумя остатками цистеина в 3-ми в 14-м положении. Он оказывает широкий спектрбиологического действия; в частности, показано ингибирующее действие насинтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез инсулина и глюкагона в β- и α-клетках островков Лангерганса.
4. Соматолиберин
недавно выделен из природных источников. Он представлен 44 аминокислотными остатками с полностью раскрытой последовательностью. Биологической активностью соматолиберина наделен, крометого, химически синтезированный декапептид: Н-Вал–Гис–Лей–Сер–Ала–Глу–Глн–Лиз–Глу–Ала-ОН. Этот декапептид стимулирует синтез и секрецию гормона роста гипофиза соматотропина.
5. Меланолиберин
, химическая структура которого аналогична структуре открытого кольца гормона окситоцина (без трипептидной боковой цепи), имеет следующее строение: Н-Цис–Тир–Иле–Глн Асн–Цис-ОН. Необходимо отметить, что меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрецию меланотропина в передней доле гипофиза.
6. Меланостатин
(меланотропинингибирующий фактор) представлен или трипептидом: Пиро-Глу–Лей–Гли-NН2, или пентапептидом со следующей последовательностью: Пиро-Глу–Гис–Фен–Aрг–Гли–NН2 . МСГ стимулируют синтез и секрецию меланинов (меланогенез) клетками - меланоцитами кожи и волос, а также пигментного слоя сетчатки глаза. Наиболее сильное влияние на пигментацию оказывает альфа-меланоцитстимулирующий гормон.
Макасеева О.Н., Дудинская, О.В., Ткаченко Л.М., Ильичева Н.И.
Р… Биологическая химия. Раздел «Белки и нуклеиновые кислоты»: конспект лекций /О.Н. Макасеева, О.В. Дудинская, Л.М. Ткаченко, Н.И. Ильичева. – Могилев: МГУП, 2014. – …… с.
ISBN ……978-985-6979-70-8 ……
ISBN …….978-985-6979-69-2.
Конспект лекций по дисциплине «Биологическая химия». Раздел «Белки и нуклеиновые кислоты» является дополнительным источником, который поможет студентам всех форм обучения освоить данную дисциплину. Конспект лекций содержит основные темы раздела «Белки и нуклеиновые кислоты» курса в соответствии с учебной программой.
Предназначается для студентов технологических специальностей пищевой промышленности.
УДК…. 547
ББК…. 24.2
1 АМИНОКИСЛОТЫ.. 4
1.1 Строение аминокислот. 4
1.2 Классификация аминокислот. 7
1.3 Общие свойства аминокислот. 9
1.3.1 Оптические свойства. 9
1.3.2 Кислотно-основные свойства аминокислот. Изоэлектрическая точка. 10
1.3.1 Химические свойства аминокислот. 14
1.3.2 Реакция меланоидинообразования. 14
2 ПЕПТИДЫ.. 16
3 БЕЛКИ.. 20
3.1 Функции белков. 20
3.2 Строение белковой молекулы.. 23
3.3 Физико-химические свойства белков. 34
3.3.1 Амфотерные свойства белков. Изоэлектрическая точка белков. 34
3.3.2 Денатурация белков. 34
3.3.3 Гидрофильные свойства белков. Высаливание белков. 37
3.4 Методы выделения белков. 40
3.5 Классификация белков. 43
4 НУКЛЕИНОВЫЕ КИСЛОТЫ.. 46
4.1 Состав нуклеиновых кислот. 46
4.2 Нуклеозиды.. 49
4.3 Нуклеотиды.. 51
4.4 Первичная структура нуклеиновых кислот. 54
4.5 Вторичная и третичная структуры ДНК.. 55
АМИНОКИСЛОТЫ
Строение аминокислот
Основной структурной единицей белков являются a-аминокислоты. В природе известно свыше 300 аминокислот, однако в состав белков входит лишь 20 a-аминокислот (одна из них – пролин, является не амино -, а имино кислотой), получивших название белковых, или протеиногенных, аминоктслот (см. Таблица 1). Все другие аминокислоты существуют в свободном состоянии или в составе коротких пептидов, или комплексов с другими органическими веществами.
a-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом у a-углеродного атома замещен на аминогруппу (–NН 2), например:
Различаются аминокислоты строением и свойствами радикалов ®. Радикалы аминокислот могут быть алифатическими, ароматическими и гетероциклическими. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме.
Именно благодаря радикалам аминокислот, белки обладают рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Значительно реже в живых организмах встречаются аминокислоты с b- или g-положением аминогруппы, например:
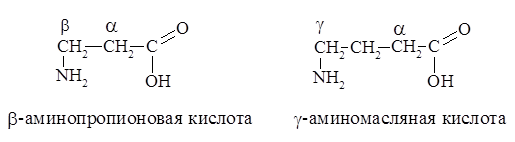
Кроме 20 стандартных аминокислот, встречающихся почти во всех белках, существуют еще нестандартные аминокислоты, являющиеся компонентами лишь некоторых типов белков – эти аминокислоты называют еще модифицированными. Около 150 из них уже выделены. Эти аминокислоты образуются после завершения синтеза белка в рибосоме клеток путем посттрансляционной химической модификации.
Таблица №1 – Строение протеиногенных аминокислот
| № | Строение аминокислоты | Сокращен. название | Название |
| 1. | Гли | Глицин | |
| 2. |  | Ала | Аланин |
| 3. |  | Вал | Валин |
| 4. |  | Лей | Лейцин |
| 5. |  | Иле | Изолейцин |
| 6. |  | Сер | Серин |
| 7. |  | Тре | Треонин |
| 8. |  | Цис | Цистеин |
| 9. |  | Мет | Метионин |
| 10. |  | Тир | Тирозин |
| 11. |  | Фен | Фенилаланин |
| 12. |  | Три | Триптофан |
| Продолжение таблицы 1 | |||
| 13. |  | Асп | Аспарагиновая кислота |
| 14. |  | Асн | Аспарагин |
| 15. |  | Глу | Глутаминовая кислота |
| 16. |  | Глн | Глутамин |
| 17. | 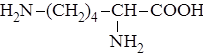 | Лиз | Лизин |
| 18. | 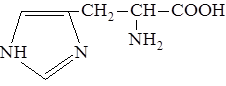 | Гис | Гистидин |
| 19. | 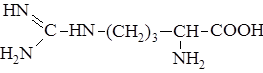 | Арг | Аргинин |
| 20. |  | Про | Пролин |
Один из примеров особенно важной модификации – окисление двух-SН–групп цистеиновых остатков с образованием аминокислоты цистина, содержащей дисульфидную связь. Так же легко происходит и обратный переход.

Таким путем образуется одна из важнейших окислительно-восстановительных систем живых организмов. В больших количествах цистин содержится в белках злаковых – клейковине, в белках волос, рогов.
Другие примеры аминокислотной модификации - гидроксипролин и гидроксилизин, которые входят в состав коллагена-основного белка соединительной ткани животных.

В состав белка протромбина (белок свертывания крови) входит
g-карбоксиглутаминовая кислота, а в ферменте глутатионпероксидазе открыт селеноцистеин, в котором (S) сера заменена на (Se) селен.

Классификация аминокислот
Существует несколько видов классификаций аминокислот входящих в состав белка.
В основу первой классификации положено химическое строение радикалов аминокислот. Различают аминокислоты:
- алифатические – глицин, аланин, валин, лейцин, изолейцин, лизин;
- гидроксилсодержащие – серин, треонин;
- ароматические – фенилаланин, тирозин, триптофан;
- гетероциклические – пролин, гистидин;
Второй вид классификации основан на полярности R-групп аминокислот. Различают:
- неполярные (гидрофобные) аминокислоты, у которых в радикале есть неполярные связи между атомами С–С, С–Н, таких аминокислот восемь: глицин, аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, пролин;
- полярные незаряженные (гидрофильные) аминокислоты, у которых в радикале есть полярные связи между атомами С–О, С–N, О–Н, S–H, таких аминокислот пять: серин, треонин, метионин, аспарагин, глутамин;
- полярные отрицательно заряженные аминокислоты, у которых в радикале есть группы, которые в водной среде при рН=7 несут отрицательный заряд, таких аминокислот четыре: тирозин, цистеин, аспарагиновая кислота, глутаминовая кислота;
- полярные положительно заряженные аминокислоты, у которых в радикале есть группы, которые в водной среде при рН=7 несут положительный заряд, таких аминокислот три: лизин, аргинин, гистидин.
Чем больше в белке аминокислот с полярными группами, тем выше его реакционная способность. От реакционной способности во многом зависят функции белка. Особенно большим числом полярных групп, характеризуются ферменты. И наоборот, их очень мало в таком белке как кератин (волосы, ногти).
Таблица 2 – Классификация аминокислот на основе полярности
| Аминокислоты | Принятые однобуквенные обозначения и символы | Изоэлектрическая точка, рI | Среднее содержание в белках,% | ||
| Англ. | символ | Русск. | |||
| 1. Неполярные R-группы | |||||
| Глицин | GLy | G | Гли | 5,97 | 7,5 |
| Аланин | ALa | A | Ала | 6,02 | 9,0 |
| Валин | VaL | V | Вал | 5,97 | 6,9 |
| Лейцин | Leu | L | Лей | 5,97 | 7,5 |
| Изолейцин | Lie | I | Иле | 5,97 | 4,6 |
| Пролин | Pro | P | Про | 6,10 | 4,6 |
| Фенилаланин | Phe | F | Фен | 5,98 | 3,5 |
| Триптофан | Trp | W | Трп | 5,88 | 1,1 |
| 2. Полярные, незаряженные R-группы | |||||
| Серин | Ser | S | Сер | 5,68 | 7,1 |
| Треонин | Thr | T | Тре | 6,53 | 6,0 |
| Метионин | Met | M | Мет | 5,75 | 1,7 |
| Аспарагин | Asn | N | Асн | 5,41 | 4,4 |
| Глутамин | GLn | Q | Глн | 5,65 | 3,9 |
| 3. Отрицательно заряженные R-группы | |||||
| Тирозин | Tyr | Y | Тир | 5,65 | 3,5 |
| Цистеин | Cys | C | Цис | 5,02 | 2,8 |
| Аспарагиновая к-та | Asp | D | Асп | 2,97 | 5,5 |
| Глутаминовая к-та | GLy | E | Глу | 3,22 | 6,2 |
| Продолжение таблицы 2 | |||||
| 4. Положительно заряженные R-группы | |||||
| Лизин | Lys | K | Лиз | 9,74 | 7,0 |
| Аргинин | Arg | R | Арг | 10,76 | 4,7 |
| Гистидин | His | N | Гис | 7,59 | 2,1 |
Третий вид классификации основан на количестве аминных и карбоксильных групп аминокислот. Они делятся на моноаминамонокарбоновые, содержащие по одной карбоксильной и амино- группе; моноаминодикарбоновые (две карбоксильные и одна амино-группа); диаминомонокарбоновые (две амино- и одна карбоксильная группа).
Четвертый вид классификации основан на способности аминокислот синтезироваться в организме человека и животных. Все аминокислоты делятся на заменимые, незаменимые и частично незаменимые.
Незаменимые аминокислоты не могут синтезироваться в организме человека и животных, они обязательно должны поступать вместе с пищей. Абсолютно незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, триптофан, метионин, лизин, фенилаланин.
Частично незаменимые - синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются арганин, гистидин.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве из других соединений. Растения могут синтезировать все аминокислоты.
Общие свойства аминокислот
Оптические свойства
В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома. Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Причем, при прохождении через них поляризованного луча происходит поворот плоскости поляризации либо в право (+), либо влево (–). По расположению атомов и атомных группировок в пространстве относительно асимметрического атома различают L - и D -стереоизомеры аминокислот. Знак и величина оптического вращения зависят от природы боковой цепи аминокислот (R-группы).
Число возможных стереоизомеров N=2 n , где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров.
В качестве стандарта при определении L и D -конфигураций аминокислот используется конфигурация стереоизомеров глицеринового альдегида.
Расположение в проекционной формуле Фишера NH 2 -группы слева соответствуют L -конфигурации, а справа – D -конфигурации.

Следует отметить, что буквы L и D означают принадлежность того или иного вещества по своей стереохимической конфигурации к L или D ряду, независимо от направленности вращения.
В составе белков обнаруживаются только L
-изомеры аминокислот.
D
-формы аминокислот в природе встречаются редко и обнаружены лишь в составе белков клеточной стенки (гликопротеинов) некоторых бактерий и в пептидных антибиотиках (грамицидин, актиномицин и т.д.). L
-формы хорошо усваиваются растениями и животными и легко включаются в обменные процессы. D-
формы не ассимилируются этими организмами, а иногда даже ингибируют процессы обмена. Это объясняется тем, что ферментативные системы организмов специфически приспособлены к L
формам аминокислот.
L и D формы аминокислот оказывают различное физиологическое воздействие на организм человека – различаются по вкусу: D- изомеры сладкие, L -формы горькие или безвкусные.
1.Предмет и задачи биологической химии. Биохимия как молекулярный уровень изучения структурной организации, анаболизма и катаболизма живой материи. Место биохимии среди других биологических дисциплин. Значение биохимии в подготовке врача и для медицины.
Биохимия – это наука о химическом составе живой материи, химических процессах, происходящих в живых организмах, а также связи этих превращений с деятельностью органов и тканей. Таким образом, биохимия состоит как бы из трех частей: 1) статическая биохимия (это анализ химического состава живых организмов); 2) динамическая биохимия (изучает совокупность превращения веществ и энергии в организме); 3) функциональная биохимия (исследует процессы, лежащие в основе различных проявлений жизнедеятельности).
Главным для биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических процессов в живом организме, а также механизм нарушения этих функций при разных заболеваниях. Современная биохимия решает следующие задачи : 1. Биотехнологическую, т.е. создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы с вредителями, пищевых добавок. 2. Проводит разработку новых методов и средств диагностики и лечения наследственных заболеваний, канцерогенеза, природы онкогенов и онкобелков. 3. Проводит разработку методов генной и клеточной инженерии для получения принципиально новых пород животных и форм растений с более ценными признаками. 4. Изучает молекулярные основы памяти, психики, биоэнергетики, питания и целый ряд других задач.
Биологическая химия изучает молекулярные процессы, лежащие в основе развития и функционирования организмов. Биохимия использует методы «молекулярных» наук - химии, физической химии, молекулярной физики, и в этом отношении биохимия сама является молекулярной наукой. Однако главные конечные задачи биохимии лежат в области биологии: она изучает закономерности биологической, а не химической формы движения материи. С другой стороны, «молекулярные изобретения» природы, открываемые биохимиками, находят применение в небиологических отраслях знания и в промышленности (молекулярная бионика, биотехнология). В таких случаях биохимия выступает в роли метода, а предметом исследований и разработок являются проблемы, выходящие за пределы биологии.
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа: поступление веществ в организм, метаболизм и выделение конечных продуктов из организма.
Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен.
Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм.
Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО 2 , Н 2 О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
Практически любое заболевание начинается с повреждения (нарушения) одной реакции в метаболизме клетки, а затем оно распространяется на ткань, орган и целый организм. Нарушение метаболизма ведет к нарушению гомеостаза в биологических жидкостях организма человека, что сопровождается изменением биохимических показателей.
Большое значение клинико-биохимических методов исследования биологических жидкостей велико в медицине и важно для подготовки медицинских лабораторных техников. Достаточно напомнить, что только в крови человека можно определить современными методами биохимических исследований около 1000 показателей метаболизма.
Биохимические показатели биологических сред организма человека широко используются при:
1. постановке диагноза заболевания, особенно дифференциального диагноза;
2. выборе метода лечения;
3.контроле за правильностью назначенного лечения;
4.результаты биохимических анализов служат одним из критериев излеченности патологического процесса;
5.скрининге (выявлении болезни на доклинической стадии);
6.мониторинге (контроле за течением заболевания и результатом лечения);
7. прогнозе (информации о возможном исходе заболевания).
2. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
Биологическая роль аминокислот и пептидов.
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. В водных растворах при нейтральном значении рН?- аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных?-аминокислот, пролин - иминокислота, радикал которой связан как с?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к?-углеродному атому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические
В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH 2), тиольная (-SH), амидная (-CO-NH 2), гидроксильная (-ОН) и гуанидиновая группы.
Для записи аминокислотных остатков в молекулах пептидов и белков используют трёхбуквенные сокращения их тривиальных названий, а в некоторых случаях и однобуквенные символы
3. Классификация аминокислот по растворимости их радикалов в воде
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают).
Аминокислоты с неполярными радикалами
К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
Аминокислоты с полярными незаряженными радикалами
Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Аминокислоты с полярными отрицательно заряженными радикалами
К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО - и Н + . Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
Аминокислоты с полярными положительно заряженными радикалами
Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н + , располагается в?-положении алифатической цепи, а у аргинина положительный заряд приобретает, гуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы - катионы.Наибольшей растворимостью в воде обладают полярные заряженные радикалы аминокислот.
4. Изменение суммарного заряда аминокислот в зависимости от рН среды
При нейтральных значениях рН все кислотные (способные отдавать Н +) и все основные (способные присоединять Н +) функциональные группы находятся в диссоциированном состоянии.
Поэтому в нейтральной среде аминокислоты, содержащие недиссоциирующий радикал, имеют суммарный нулевой заряд. Аминокислоты, содержащие кислотные функциональные группы, имеют суммарный отрицательный заряд, а аминокислоты, содержащие основные функциональные группы, - положительный заряд
Изменение рН в кислую сторону (т.е. повышение в среде концентрации Н +) приводит к подавлению диссоциации кислотных групп. В сильно кислой среде все аминокислоты приобретают положительный заряд.
Напротив, увеличение концентрации ОН - групп вызывает отщепление Н + от основных функциональных групп, что приводит к уменьшению положительного заряда. В сильно щелочной среде все аминокислоты имеют суммарный отрицательный заряд.
5. Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты - производные одной из этих 20 аминокислот.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза. Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства, необходимые для выполнения ими специфических функций.
6. Химические реакции, используемые для обнаружения аминокислот
Для обнаружения и количественного определения аминокислот, находящихся в растворе, можно использовать нингидриновую реакцию.
Эта реакция основана на том, что бесцветный нингидрин, реагируя с аминокислотой, конденсируется в виде димера через атом азота, отщепляемый от?-аминогруппы аминокислоты. В результате образуется пигмент красно-фиолетового цвета. Одновременно происходит декарбоксилирование аминокислоты, что приводит к образованию СО 2 и соответствующего альдегида. Нингидриновую реакцию широко используют при изучении первичной структуры белков Так как интенсивность окраски пропорциональна количеству аминокислот в растворе, её используют для измерения концентрации?-аминокислот.
Специфические реакции на отдельные аминокислоты
Качественное и количественное определение отдельных аминокислот возможно благодаря наличию в их радикалах особенных функциональных групп.
Аргинин определяют с помощью качественной реакции на гуанидиновую группу (реакция Сакагучи), а цистеин выявляют реакцией Фоля, специфичной на SH-группу данной аминокислоты. Наличие ароматических аминокислот в растворе определяют ксантопротеиновой реакцией (реакция нитрования), а наличие гидроксильной группы в ароматическом кольце тирозина - с помощью реакции Миллона.
Б. Пептидная связь. Строение и биологические свойства пептидов
3.Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Функции пептидов зависят от их первичной структуры. Ангиотензин I по структуре очень похож на ангиотензин II (имеет только две дополнительные аминокислоты с С-конца), но при этом не обладает биологической активностью.
Изменение в аминокислотном составе пептидов часто приводит к потере одних и возникновению других биологических свойств.
Так как пептиды - мощные регуляторы биологических процессов, их можно использовать как лекарственные препараты. Основное препятствие для терапевтического использования - их быстрое разрушение в организме. Одним из важнейших результатов исследований является не только изучение структуры пептидов, но и получение синтетических аналогов природных пептидов с целенаправленными изменениями в их структуре и функциях.
Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон, глюкагон и др.);
пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестиналшый пептид, желудочный ингибирующий пептид и др.);
пептиды, регулирующие тонус сосудов и АД (брадикинин, калидин, ангиотензин II);
пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, (?-эндорфины);
пептиды, обладающие обезболивающим действием (энкефалины и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и т.д.
3. Первичная структура белков. Пептидная связь, ее характеристика (прочность, кратность, компланарность, цис- ,транс- изомерия). Значение первичной структуры для нормального функционирования белков (на примере гемоглобина S ).
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости;
способность существовать в двух резонансных формах (кето- или енольной форме);
транс-положение заместителей по отношению к С-N-связи;
способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь. Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
Особенности первичной структуры белка . В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (-СНR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
2.Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу.
Связь между?-углеродным атомом и?-аминогруппой или?-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. ?-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве.
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами.
Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию (положительный результат для веществ, содержащих в своём составе не менее двух пептидных связей).
Химическая природа каждого белка уникальна и тесно связана с его биологической функцией. Способность белка выполнять присущую ему функцию определяется его первичной структурой. Даже небольшие изменения в последовательности аминокислот в белке могут привести к серьезному нарушению в его функционировании, возникновению тяжелого заболевания. Болезни, связанные с нарушениями первичной структуры белка, получили название молекулярных. К настоящему времени открыто несколько тысяч таких болезней. Одной из молекулярных болезней является серповидноклеточная анемия, причина которой кроется в нарушении первичной структуры гемоглобина. У людей с врожденной аномалией структуры гемоглобина в полипептидной цепочке, состоящей из 146 аминокислотных остатков, в шестом положении находится валин, тогда как у здоровых людей на этом месте - глутаминовая кислота. Аномальный гемоглобин хуже транспортирует кислород, а эритроциты крови больных имеют серповидную форму. Заболевание проявляется в замедлении развития, общей слабости организма.
ОПРЕДЕЛЕНИЕ
Аминокислоты - это сложные органические соединения, которые в своей молекуле одновременно содержат аминогруппу и карбоксильную группу.
Аминокислоты представляют собой твердые кристаллические вещества, характеризующиеся высокими температурами плавления и разлагающиеся при нагревании. Они хорошо растворяются в воде. Данные свойства объясняются возможностью существование аминокислот в виде внутренних солей (рис. 1).
Рис. 1. Внутренняя соль аминоуксусной кислоты.
Получение аминокислот
Исходными соединениями для получения аминокислот часто служат карбоновые кислоты, в молекулу которых вводится аминогруппа. Например, получение их из галогензамещенных кислот
CH 3 -C(Br)H-COOH + 2NH 3 →CH 3 -C(NH 2)H-COOH + NH 4 Br.
Кроме этого исходным сырьем для получения аминокислот могут служить альдегиды (1), непредельные кислоты (2) и нитросоединения (3):
CH 3 -C(O)H + NH 3 + HCN → CH 3 -C(NH 2)H-C≡H + H 2 O;
CH 3 -C(NH 2)H-C≡H + H 2 O (H +) → CH 3 -C(NH 2)H-COOH + NH 3 (1).
CH 2 =CH-COOH + NH 3 → H 2 N-CH 2 -CH 2 -COOH (2);
O 2 N-C 6 H 4 -COOH + [H] →H 2 N-C 6 H 4 -COOH (3).
Химические свойства аминокислот
Аминокислота как гетерофункциональные соединения вступают в большинство реакций, характерных для карбоновых кислот и аминов. Наличие в молекулах аминокислот двух различных функциональных групп приводит к появлению ряда специфических свойств.
Аминокислоты - амфотерные соединения. Они реагируют как с кислотами, так и с основаниями:
NH 2 -CH 2 -COOH + HCl→ Cl
NH 2 -CH 2 -COOH + NaOH→ NH 2 -CH 2 -COONa + H 2 O
Водные растворы аминокислот имеют нейтральную, щелочную и кислотную среду в зависимости от количества функциональных групп. Например, глутаминовая кислота образует кислый раствор, поскольку в её составе две карбоксильные группы и одна аминогруппа, а лизин - щелочной раствор, т.к. в её составе одна карбоксильная группа и две аминогруппы.
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:
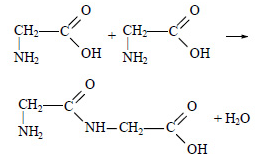
Полученное соединение называют дипептидом. Вещества, построенные из многих остатков аминокислот, называются полипептидами. Пептиды гидролизуются под действием кислот и оснований.
Применение аминокислот
Аминокислоты, необходимые для построения организма, как человек, так и животные получают из белков пищи.
γ-Аминомасляная кислота используется в медицине (аминалон / гаммалон) при психических заболеваниях; на её основе создан целый ряд ноотропных препаратов, т.е. оказывающих влияние на процессы мышления.
ε-Аминокапроновая кислота также используется в медицине (кровоостанавливающее средство), а кроме того представляет собой крупнотоннажный промышленный продукт, использующийся для получения синтетического полиамидного волокна - капрона.
Антраниловая кислота используется для синтеза красителей, например синего индиго, а также участвует в биосинтезе гетероциклических соединений.
Примеры решения задач
ПРИМЕР 1
| Задание | Напишите уравнения реакций аланина с: а) гидроксидом натрия; б) гидроксидом аммония; в) соляной кислотой. За счет каких групп внутренняя соль проявляет кислотные и основные свойства? |
| Ответ | Аминокислоты часто изображают как соединения, содержащие аминогруппу и карбоксильную группу, однако с такой структурой не согласуются некоторые их физические и химические свойства. Строение аминокислот соответствует биполярному иону:
H 3 N + -CH(R)-COO — . Запишем формулу аланина как внутренней соли: H 3 N + -CH(CH 3)-COO — . Исходя из этой структурной формулы, напишем уравнения реакций: а) H 3 N + -CH(CH 3)-COO — + NaOH = H 2 N-CH(CH 3)-COONa + H 2 O; б) H 3 N + -CH(CH 3)-COO — + NH 3 ×H 2 O = H 2 N-CH(CH 3)-COONH 4 + H 2 O; в) H 3 N + -CH(CH 3)-COO — + HCl = Cl — . Внутренняя соль аминокислоты реагирует с основаниями как кислота, с кислотами - как основание. Кислотная группа - N + H 3 , основная - COO — . |
ПРИМЕР 2
| Задание | При действии на раствор 9,63 г неизвестной моноаминокарбоновой кислоты избытком азотистой кислоты было получено 2,01 л азота при 748 мм. рт. ст. и 20 o С. Определите молекулярную формулу этого соединения. Может ли эта кислоты быть одной из природных аминокислот? Если да, то какая это кислота? В состав молекулы этой кислоты не входит бензольное кольцо. |
| Решение | Напишем уравнение реакции:
H 2 NC x H 2 x COOH + HONO = HO-C x H 2 x -COOH + N 2 + H 2 O. Найдем количество вещества азота при н.у., применяя уравнение Клапейрона-Менделеева. Для этого температуру и давление выражаем в единицах СИ: T = 273 + 20 = 293 K; P = 101,325 × 748 / 760 = 99,7 кПа; n(N 2) = 99,7 × 2,01 / 8,31 × 293 = 0,082 моль. По уравнению реакции находим количество вещества аминокислоты и её молярную массу. По уравнению n(H 2 NC x H 2 x COOH) = n(N 2) = 0,082 моль. M(H 2 NC x H 2 x COOH) = 9,63 / 0,082 = 117 г/моль. Определим аминокислоту. Составим уравнение и найдем x: 14x + 16 + 45 = 117; H 2 NC 4 H 8 COOH. Из природных кислот такому составу может отвечать валин. |
| Ответ | Эта аминокислота — валин. |
